方案详情9�/div>
流式动态图像法粒度仪助�?/span>轻松识别注射剂中的玻璃颗粑�/span>
包括生物制药在内的注射剂药物(非肠道药物)通常使用玻璃瓶作为主要容器。肠胃外产品中可见颗粒的存在可能会给患者带来安全隐悢�/span>[1]。肠胃外产品召回的十大原因之一是存在可见颗粑�/span>[2]。药品制造商负责确保装量玻璃瓶适用于其产品和工艺。玻璃用作医药产品容器的基础是具有化学惰性、物理和尺寸稳定性以及优异的透明度。药品及玻璃容器不应与内容药物发生物理或化学作用[3]、�/span>
然而,玻璃不是完全惰性的,它可以被不同的溶液介质[4-6]侵蚀。其性能受玻璃管制成的小瓶的制造工艺的影响[7]、�/span>2010平�/span>9月,安进'�/span>Amgen)和美国食品药品监督管理局'�/span>FDA)通知卫生保健专业人士,为了预防起见,召回了一亚�/span>Epogen咋�/span>Procrit'�/span>Epoetin alfa)小瓶,因为这些小瓶可能含有几乎看不见的极薄玻璃片(薄片(�/span>[8]、�/span>
在非肠道产品的生命周期中,玻璃容器的内表面受到各种应力,包括化学应力、热应力和机械应力,这些应力可能导致玻璃容器产生各种不同尺寸、形状和形态的玻璃颗粒。在Wen[9]等人的研究中,他们根据玻璃颗粒的物理和化学特性将颗粒分为三类:玻璃碎片、玻璃薄片和硅胶、�/span>
注射剂中不同类型的玻璃颗粒来溏�/span>
玻璃碎片是由于机械力而从玻璃容器上脱落的固体玻璃碎片。它们通常在三维上很厚,具有不规则的轮廓,并且在观察时以稀疏的数量存在(例如,每个容器1戕�/span>2个),并且由罕见的机械事件引起。机械力可能来自运输过程中的震动,也可能来自瓶塞的加盖和摘帽。在运输过程中发生晃动的情况下,受影响的部位通常位于药瓶肩部区域、�/span>
玻璃薄片,通常非常薄、易碎、反光,在观察时存在相对丰富(每个容器多片),长度和宽度多分散。玻璃薄片通常是由玻璃表面的损坏引起,它们是从玻璃容器的内表面剥离的薄玻璃板,分层是由于化学或机械应力削弱了玻璃网络而发生、�/span>
硅胶颗粒通常是无定形的,呈半透明至白色,观察时大量存在(每个容器多个),在高温下储存时可能会溶解。它们是无定形沉淀或硅酸聚集体,这是由于玻璃瓶在不利条件下(例如,中性至碱�?/span>pH溶液并储存更长时间)发生了玻璃溶觢�/span>[10]、�/span>
YH-FIPS流式动态图像法粒度仪轻松识别注射剂中的玻璃颗粒
玻璃瓶已被用作包括生物制药在内的非肠道药物的主要容器,不同类型的玻璃相关颗粒,虽然形成的可能性较低,但仍然可能会被意外引入至非肠道药物甚至人体中。对这些玻璃相关颗粒的正确分类和研究可能有助于了解它们的形成,改善制备工艺的控制,减少药物制剂中的玻璃相关颗粒,并向患者提供安全的非肠道药物、�/span>
采用视觉方法对注射剂中的玻璃颗粒进行筛查存在一定的局限性,胤煌科技'�/span>YinHuang Technology)推出的YH-FIPS流式动态图像法粒度仪具有独特的专利算法轻松识别注射剂中的玻璃颗粒、�/span>

国�/span>19�/span>YH-FIPS系列流式动态图像法粒度�?/span>
技术优势:
�宽广的检测范围(0.2 μm-3 mm)、检测浓度可高达1*107�?/span>/mL:�/span>
�专业远心变倍镜头,兼容不同类型粒子测试,杜绝形貌畸变;
�引入FIPS超分辨算法及AI智能算法等多种算法,确保数据准确性;
�数据同时给出粒子形貌、尺寸分布等信息,以达到最‛�span style="font-family:宋体">眞�/span>“�span style="font-family:宋体">统计:�/span>
�符合21 CFR part 11叉�/span>GMP对数据完整性的要求、�/span>
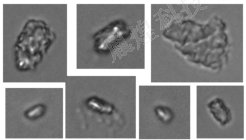
国�/span>2:使�?/span>YH-FIPS系列流式动态图像法粒度仪对某注射剂进行检测得到的玻璃颗粒的部分图片,玻璃颗粒的典型图像特征是具有一定的透明度与光泽、�/span>
胤煌科技(YinHuang Technology)是一家专注于为医药、半导体及化工材料等行业提供检测分析设备及技术服务的高科技公司,致力于为客户提供全面、准确的检测分析和解决方案。主营产品包括不溶性微粒分析仪,可见异物检查分析仪,原液粒度及Zeta电位分析仪,CHDF高精度纳米粒度仪,高分辨纳米粒度仪,溶液颜色测定仪,澄清度测定仪等,公司自主研发皃�/span>YH-MIP系列显微计数法不溶性微粒仪�?/span>YH-FIPS系列流式动态图像法粒度仪,YH-FIPS系列微流成像颗粒分析仪已经在生物医药、半导体及材料化工领域得到广泛应�?/span>.
[1]. Doessegger, L.; Mahler, H. C.; Szczesny P. The potential clinical relevance of visible particles in parenteral drugs. J Pharm. Sci. 2012, 101 (8), 2635�?644.
[2]. Shabushnig, J. G. Visual inspection—more than separating good from bad. Seminar of the New
England Chapter of the Parenteral Drug Association, Lexington, MA, February 9, 2005.
[3]. Chapter 3.2.1 Glass Containers for Pharmaceutical Use. European Pharmacopoeia, 7th ed.; p 363.
4. Brown, J. B.; Watts, A. S. Some studies on reactions between glasses and phosphate solutions. J. Amer. Ceram. Soc. 1937, 20 (1-12), 245�?50.
[5]. Dimbleby, V. Glass for pharmaceutical purposes. J. Pharm. Pharmacol. 1953, 5 (1), 969 �?89.
[6]. Bacon, F. R.; Raggon, F. C. Promotion of attack on glass and silica by citrate and other anions in
neutral solution. J. Am. Chem. Soc. 1952, 42 (4), 199 �?05.
[7]. Ennis, R. D.; Pritchard, R.; Nakamura, C. Glass vials for small volume parenterals: influence of drug and manufacturing processes on glass delamination. Pharm. Technol. Conf. 2001, 6 (3), 393� 405.
[8]. Epogen and Procrit (epoetin alfa): Recall—Particulate Matter in Vials, September 4, 2010; U.S. Food and Drug Administration, Safety Information and Adverse Event Reporting Program.
[9].Guiyang Li, Shawn Cao, Nancy Jiao.Classification of Glass Particles in Parenteral Product Vials by Visual, Microscopic, and Spectroscopic Methods.FDA.J. Pharm. Sci and.Technol.2014, 68, 236-372
[10]. Hair, A.; Li, G.; Thirumangalathu, R.; Piedmonte,D.; Nashed-Samuel, Y.; Karamujic, L.; Dharma-varam, V.; Wen, Z. Q.; Fujimori, K.; Jing, W.; Sethuraman, A.; Swift, R.; Ratnaswamy, G. Implication of silica dissolution in neutral pH formulation. J. Pharm. Sci. Submitted.

 金牌会员
金牌会员
 已认�?/p>
已认�?/p>