 й’»зҹідјҡе‘ҳ
й’»зҹідјҡе‘ҳ
 е·Іи®ӨиҜ?/p>
е·Іи®ӨиҜ?/p>
зІ’еҫ„жҺ§еҲ¶еҜ№и„ӮиҙЁдҪ“иҪҪиҚҜзҡ„йҮҚиҰҒдҪңз”ЁеҸҠзӣёе…іжЈҖжөӢж–№жі”ь/span>
ж‘ҳиҰҒпјҷь/span>и„ӮиҙЁдҪ“дҪңдёәиҚҜзү©иҪҪдҪ“пјҢжҺ§еҲ¶е…¶зІ’еҫ„еӨ§е°ҸжҳҜеҝ…иҰҒзҡ„гҖӮеҠЁжҖҒе…үж•Је°„жі•е’ҢеҚ•йў—зІ’е…үеӯҰдј ж„ҹжҠҖжңҜеҸҜеҲҶеҲ«еҜ№дәҡеҫ®зұігҖҒеҫ®зұізә§еҲ«зҡ„зІ’еҫ„иҝӣиЎҢеҲҶжһҗпјҢзҫҺеӣҪиҚҜе…ёдёӯеҜ№зІ’еҫ„еҲҶеёғжңүжҳҺзЎ®зҡ„规е®ҡгҖӮйҖҡиҝҮе®һйӘҢйӘҢиҜҒдәҶзҫҺеӣјь/span>PSSе…¬еҸёзҡғь/span>Nicomp380/ZLSжҝҖе…үзІ’еҫ„жЈҖжөӢд»ӘгҖ?/span>AccuSizer780Aе…үеӯҰзІ’еҫ„жЈҖжөӢд»Әзҡ„з»“еҗҲдҪҝз”ЁпјҢеҸҜд»ҘеҜёь/span>зІ’еҫ„иҝӣиЎҢжӣҙе…Ёйқўз§‘еӯҰзҡ„иҙЁйҮҸжҺ§еҲ¶гҖҒь/span>
е…ій”®иҜҚпјҡи„ӮиҙЁдҪ“пјӣзІ’еҫ„еҲҶеёғпјӣжЈҖжөӢж–№жі•пјӣUSP729пјҡь/span>PFAT5
дёҖгҖҒи„ӮиҙЁдҪ“зҡ„з®Җд»Ҡь/span>
и„ӮиҙЁдҪ’ь/span> (liposome)зҡ„иҚҜеүӮеӯҰе®ҡд№үпјҢжҳҜжҢҮе°ҶиҚҜзү©еҢ…е°ҒдәҺзұ»и„ӮиҙЁеҸҢеҲҶеӯҗеұӮеҶ…иҖҢеҪўжҲҗзҡ„еҫ®еһӢжіЎеӣҠдҪ“гҖӮи„ӮиҙЁдҪ“зҡ„дё»иҰҒзұ»еһӢжңүеҚ•еұӮе°ҸжіЎ(SUV)гҖҒе°ҸеӨҡеұӮе°ҸжіЎ(SMV)гҖҒеӨҡеұӮе°Ҹжі ь/span>(MLV)гҖҒеӨ§еҚ•еұӮе°ҸжіЎ(LUV)е’Ңе·ЁеһӢеӨҡеұӮе°Ҹжі ь/span>(GMV)гҖӮи„ӮиҙЁдҪ“жҳҜйҰ–дёӘиў«жҲҗеҠҹеә”з”ЁдәҺдёҙеәҠзҡ„зәізұіиҚҜзү©иҫ“йҖҒзі»з»ҹпјҢи„ӮиҙЁдҪ“зҡ„еӨ§е°Ҹе’ҢиҪҪиҚҜйҮҸеңЁиҚҜзү©зҡ„иҚҜд»ЈеҠЁеҠӣеӯҰе’ҢиҚҜж•ҲеӯҰеҸӮж•°дёӯиө·зқҖе…ій”®дҪңз”ЁгҖӮеӣ жӯӨпјҢеҮҶзЎ®е’Ңеҝ«йҖҹзҡ„жөӢйҮҸи„ӮиҙЁдҪ“зҡ„еӨ§е°ҸжҳҜеҝ…дёҚеҸҜе°‘зҡ„ж–°еһӢе’Ңжңүж•Ҳзҡ„з»ҷиҚҜзі»з»ҹгҖҒь/span>
дәҢгҖҒи„ӮиҙЁдҪ“зІ’еҫ„зҡ„жЈҖжөӢж–№жі”ь/span>
и„ӮиҙЁдҪ“зҡ„зІ’еҫ„йҖҡеёёйҮҮз”ЁеҠЁжҖҒе…үе…үж•Је°„жі•пјҮь/span>Dynamic Light Scattering, DLSпјүеҸҠеҚ•йў—зІ’е…үеӯҰдј ж„ҹжҠҖжңҜпјҲSingle Particle Optical Sensing, SPOSпјүгҖӮеҠЁжҖҒе…үж•Је°„жі•жҳҜжөӢе®ҡдәҡеҫ®зұіи„ӮиҙЁдҪ“еӨ§е°ҸжңҖеёёз”Ёзҡ„еҲҶжһҗжҠҖжңҜпјҢеҚ•йў—зІ’е…үеӯҰдј ж„ҹжҠҖжң?/span>(SPOS)з”ЁдәҺжөӢйҮҸеӨ§дәҺ1Ојmзҡ„и„ӮиҙЁдҪ“зҡ„еӨ§е°ҸгҖҒь/span>
дёүгҖҒи„ӮиҙЁдҪ“зІ’еҫ„зҡ„жҺ§еҲөь/span>
Maryam Amidi, Markus de Raadзӯүдәә[1]иҝӣиЎҢдәҶжҠ—еҺҹиЎЁиҫҫе…Қз–«еҲәжҝҖи„ӮиҙЁдҪ“зҡ„зӣёе…із ”究пјҢиҜҘз ”з©¶дҪҝз”Ёи„ӮиҙЁдҪ“дҪңдёәдәәе·ҘжҺҘз§Қеҫ®з”ҹзү©пјҢиҝҷдәӣдәәе·Ҙеҫ®з”ҹзү©еҸҜд»ҘйҖҡиҝҮеҹәеӣ зј–зЁӢйҡҸеҝғжүҖж¬Іең°дә§з”ҹзү№е®ҡзҡ„жҠ—еҺҹгҖӮе°Ҷз»ҶиҸҢдҪ“еӨ–иҪ¬еҪ•е’Ңзҝ»иҜ‘зі»з»ҹд»ҘеҸҠзј–з ҒжЁЎеһӢжҠ—еҺһь/span>b-еҚҠд№ізі–иӢ·й…¶зҡ„еҹәеӣ жһ„е»әеҢ…еҹӢеңЁеӨҡеұӮи„ӮиҙЁдҪ“дёӯгҖӮи„ӮиҙЁдҪ“зҡ„дҪ“з§ҜеҠ жқғе№іеқҮзӣҙеҫ„е’ҢеӨ§е°ҸеҲҶеёғз”ұеҚ•йў—зІ’е…үеӯҰдј ж„ҹ(AccusizerTM780, Santa Barbara, California, USA)жөӢе®ҡгҖҒь/span>ОІ-еҚҠд№ізі–иӢ·й…¶и„ӮиҙЁдҪ“е’Ӣь/span>AnExILпјҲиЎЁиҫҫжҠ—еҺҹзҡ„е…Қз–«еҲәжҝҖи„ӮиҙЁдҪ“пјүеҲ¶еүӮзҡ„дҪ“з§ҜеҠ жқғе№іеқҮзІ’еҫ„зәҰдё№ь/span>1.5 ОјmгҖӮз ”з©¶иЎЁжҳҚь/span>[2]пјҢзІ’еҫ„еңЁ20~200nmд№Ӣй—ҙзҡ„и„ӮиҙЁдҪ“жҳҜеұҖйғЁеә”з”ЁиҚҜзү©йҖҡиҝҮз»Ҷиғһй—ҙжё—йҖҸйҖ”еҫ„иҝӣе…Ҙжҙ»иЎЁзҡ®зҡ„жҙ»жҖ§иҪҪдҪ“гҖҒь/span>
жқЁиүіиҠІь/span>гҖҒи°ўеҗ‘йҳізӯүдәә[3]еҜ№дәҺзІ’еҫ„дёҺиЎЁйқўз”өиҚ·еҪұе“Қи„ӮиҙЁдҪ“дҪ“еҶ…иҚҜзү©йқ¶еҗ‘йҖ’йҖҒиҝӣиЎҢдәҶзӣёе…ізҡ„жҺўи®ЁпјҢзІ’еӯҗеӨ§е°Ҹең?/span>100nmд»ҘеҶ…е…·жңүй«ҳйҖҸиҶңжҖ§пјҢ100~200nmзҡғь/span>е…·жңүиҫғй«ҳзҡ„йҖҸиҶңжҖ§гҖӮзәізұізІ’еӯҗзҡ„йҖҸиҶңжҖ§йҡҸе…¶зІ’еҫ„зҡ„еўһеҠ иҖҢеҮҸе°‘пјҢиў«еҠЁиҪ¬иҝҗиҶңзҡ„зІ’еҫ„дёҙз•ҢеҖјдёә500nmпјҢеӨ§дәҚь/span>500nmзҡ„зІ’еӯҗеҫҲйҡҫи·Ёи¶ҠжһҒжҖ§дёҠзҡ®з»Ҷиғһиҝӣе…ҘеҫӘзҺҜзі»з»ҹгҖӮзІ’еҫ„дёә500nm~10Ојmзҡ„еӣәдҪ“йў—зІ’еқҮеҸҜиў«еҗһеҷ¬жҖ§з»ҶиғһжүҖж‘„еҸ–пјҢдё”з»Ҷиғһеҗһеҷ¬дҪңз”ЁйҡҸе…¶зІ’еҫ„зҡ„еўһеӨ§иҖҢеўһеј№ь/span>[4,5]гҖҒь/span>
и„ӮиҙЁдҪ“зҡ„зІ’еҫ„еҗҢж ·д№ҹеҪұе“Қи„ӮиҙЁдҪ“еҜ№иӮҝзҳӨз»„з»Үзҡ„йқ¶еҗ‘жҖ§гҖӮи„ӮиҙЁдҪ“зҡ„зІ’еҫ„еҝ…йЎ»еӨ§дәҚь/span>10nm,д»ҘйҒҝе…ҚиӮҫи„Ҹж»ӨиҝҮж•Ҳеә”гҖӮи„ӮиҙЁдҪ“еҸҜд»ҘеҸ‘з”ҹEPRж•Ҳеә”пјҮь/span>enhanced permeability and retention effectпјҢеўһеҠ зҡ„жё—йҖҸжҖ§е’Ңдҝқз•ҷж•Ҳеә”пјүзҡ„жңҖеӨ§зІ’еҫ„з”ұеӨҡдёӘеӣ зҙ еҶіе®ҡгҖӮдҪңдёәиў«еҠЁйқ¶еҗҗь/span>,е…¶е®Ңе…Ёдҫқиө–дәҺжү©ж•Ји°ғиҠӮзҡ„иҚҜзү©иҝҗиҫ“жңәеҲ¶гҖҒь/span>DreherзӯҲь/span>[6]жҠҘйҒ“,зІ’еҫ„дёәеҮ зҷҫзәізұізҡ„зІ’еӯҗе®№жҳ“еңЁиӮҝзҳӨз»„з»ҮдёӯзҙҜз§ҜпјӢь/span>иҺ·еҫ—EPRж•Ҳеә”зҡ„и„ӮиҙЁдҪ“жІүз§Ҝзҡ„зІ’еҫ„дёҠйҷҗдёә400nmпјҢеӨ§дәҚь/span>400nmзҡ„и„ӮиҙЁдҪ“дёҚиғҪжү©ж•ЈйҖҡиҝҮиӮҝзҳӨй—ҙйҡҷгҖӮиӮҝзҳӨиЎҖз®ЎејҖеӯ”зҡ„еӯ”еҫ„ең?/span>50~100nmпјҢжҳҜйҷҗеҲ¶и„ӮиҙЁдҪ“жё—йҖҸиҝӣе…ҘиӮҝзҳӨз»„з»Үзҡ„йҮҚиҰҒйҖ”еҫ„гҖӮз»јеҗҲжқҘиҜҙпјҢи„ӮиҙЁдҪ“йҖҡиҝҮEPRж•Ҳеә”еңЁиӮҝзҳӨз»„з»Үз§ҜиҒҡзҡ„жңүж•ҲзІ’еҫ„иҢғеӣҙдё№ь/span>10~150nmгҖҒь/span>
еӣӣгҖҒзІ’еҫ„жҺ§еҲ¶зҡ„йҮҚиҰҒжҖ?/span>
д№Іь/span>еүӮзҡ„е№іеқҮзІ’еҫ„еҲҶеёғе’ҢзІ’еәҰеӨ§е°ҸдёҺжңүж•ҲжҖ§е’Ңе®үе…ЁжҖ§жңүзӣҙжҺҘе…іиҒ”[7]гҖӮеңЁеҢ»иҚҜиЎҢдёҡпјӢь/span>жіЁе°„еүӮдёӯзҡ„еӨ§йў—зІ’дјҡдјҙйҡҸзқҖжіЁе°„иҝҮзЁӢиҝӣе…ҘдәәдҪ“иӮәйғЁпјҢйҖ жҲҗиӮәйғЁиӮүиҠҪиӮҝпјҲзҫҺеӣҪжӣҫз»ҸеҸ‘з”ҹиҝҮеӨ§зІ’еӯҗеј•иө·зҡ„еҢ»з–—дәӢ件пјҢиҝҷжҳҜдҝғжҲҗзҫҺеӣҪиҚҜ典委е‘ҳдјҡеҜ№еӨ§зІ’еӯҗе…іжіЁзҡ„иө·еӣ пјүгҖҒь/span>дё”д№іеүӮдёӯеӨ§зІ’еӯҗзҡ„еӯҳеңЁдјҡеҠ йҖҹд№іж»ҙзҡ„иҒҡйӣҶдҪңз”ЁпјҢдјҡйҖ жҲҗд№іж»ҙзҡғь/span>зө®еҮқпјҢеҮқз»“пјҢеҮәзҺ°зӣёеҲҶзҰ»зҺ°иұЎгҖӮдёҖиҲ¬жқҘиҜҙпјҢд№іеүӮзҡ„зІ’еҫ„дҝқжҢҒеңЁ0.2~0.5ОјmеҸҜд»ҘдҝқжҢҒжңҖеҘҪзҡ„зү©зҗҶзЁіе®ҡжҖ?/span>[8]пјҢдё”жҳ“иў«дәәдҪ“еҗёж”¶гҖӮиҖҢдәәиӮәйғЁзҡ„жҜӣз»ҶиЎҖз®ЎеңЁ4Ојm~9Ојmд№Ӣй—ҙпјҢиӢҘи„ӮиӮӘд№іеҗ«жңүеӨ§дәҚь/span>5Ојmзҡ„зІ’еӯҗпјҢжҲ–иҖ…зІ’еӯҗдёҚеӨҹзЁіе®ҡпјҢеңЁж”ҫзҪ®иҝҮзЁӢдёӯжңүеҸҜиғҪеҗҲ并жҲҗдёәеӨ§дәҚь/span>5Ојmзҡ„зІ’еӯҗпјҢе°ұдјҡеңЁиӮәйғЁеҸ‘з”ҹж “еЎһпјҢдё”еӨ§зІ’еӯҗеҜ№иӮқи„Ҹдә§з”ҹжҚҹдјӨгҖӮеӣ жӯӨи„ӮиӮӘд№іжіЁе°„ж¶ІиҙЁйҮҸжҺ§еҲ¶е…ій”®иҰҒжҺ§еҲ¶е№іеқҮзІ’еҫ„пјҲе°ҸдәҚь/span>0.5Ојmпјүе’ҢеӨ§дәҺ5ОјmзІ’еӯҗзҡ„жҜ”дҫӢгҖҒь/span>
дә”гҖҒзІ’еҫ„зҡ„еҲҶжһҗ
дёӯеӣҪеҢ»иҚҜе·Ҙдёҡз ”з©¶жҖ»йҷўзҡ„жҪҳдјҹзҘҘгҖҒеҲҳжҙҒзӯүдә№ь/span>[9]еҲ©з”ЁдәҶзҫҺеӣјь/span>ParticleSizingSystemsе…¬еҸёзҡғь/span>Nicomp380/ZLSжҝҖе…үзІ’еҫ„жЈҖжөӢд»ӘгҖ?/span>AccuSizer780Aе…үеӯҰзІ’еҫ„жЈҖжөӢд»ӘеҜ№еүҚеҲ—ең°е°”жіЁе°„ж¶Ій…ҚдјҚе®һйӘҢдёӯд№ізІ’зЁіе®ҡжҖ§иҝӣиЎҢдәҶжҺўи®ЁпјҢз»“жһңиЎЁжҳҺпјҢеҠЁжҖҒе…үж•Је°„жі•йҖӮз”ЁдәҺжөӢйҮҸд№ізІ’зҡ„е№іеқҮзІ’еҫ„пјҢиҖҢе…үж¶ҲеҮҸ-еҚ•зІ’еӯҗе…үеӯҰдј ж„ҹжі•жҳҜиҜ„件ь/span>еӨ§зІ’еӯҗзІ’еҫ„еҲҶеёғжӣҙдёәжңүж•Ҳзҡ„ж–№жі•пјӢь/span>еӣ жӯӨе»әи®®йҮҮз”Ё2з§Қж–№жі•зӣёз»“еҗҲпјӢь/span>д»ҺиҖҢеҜ№д№іеүӮзҡ„зІ’еҫ„иҝӣиЎҢжӣҙе…Ёйқўз§‘еӯҰзҡ„иҙЁйҮҸжҺ§еҲөь/span>(еҢ…жӢ¬е№іеқҮзІ’еҫ„е’ҢеӨ§зІ’еӯҗ)гҖҒь/span>
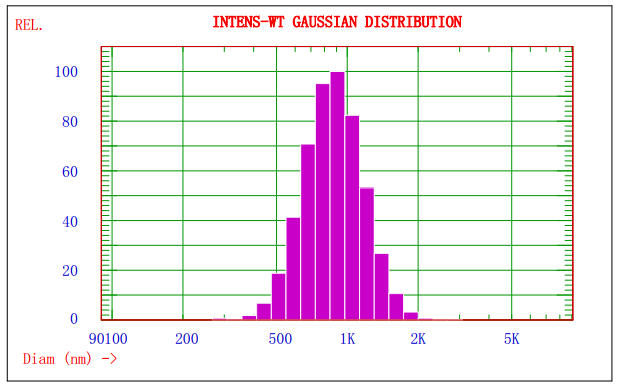
еӣҪь/span>1.Nicomp380/ZLSеҜёь/span>жҹҗд№іеүӮж ·е“Ғзҡ„е…үејәеҫ„й«ҳж–ҜеҲҶеёғи°ұеӣҪь/span>
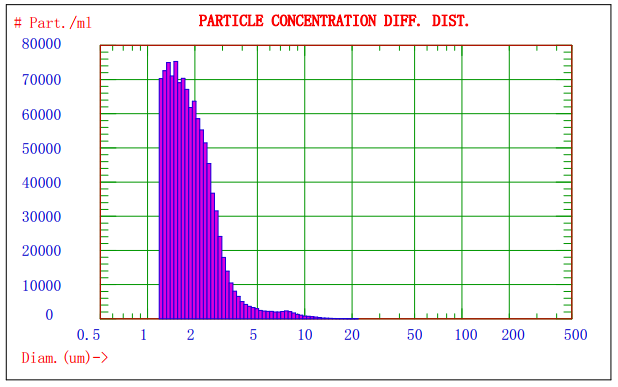
еӣҪь/span>2.AccuSizer780еҜ№жҹҗд№іеүӮж ·е“ҒеҲҶжһҗзҡ„зІ’еҫғь/span>-ж•°йҮҸеҲҶеёғеӣҪь/span>
еӣҪь/span>1жҳҫзӨәзҡ„жҳҜNicomp380/ZLSжҝҖе…үзІ’еҫ„жЈҖжөӢд»ӘеҜ№жҹҗд№іеүӮж ·е“ҒеҲҶжһҗзҡ„е…үејәеҫ„й«ҳж–ҜеҲҶеёғи°ұеӣҫпјҢз”ұеӣҪь/span>1еҸҜзҹҘиҜҘд№іеүӮзҡ„е№іеқҮзІ’еҫ„зәҰдёә908nmпјӣеӣҫ2жҳҫзӨәзҡ„жҳҜAccuSizer780Aе…үеӯҰзІ’еҫ„жЈҖжөӢд»ӘеҜ№жҹҗд№іеүӮж ·е“ҒеҲҶжһҗзҡ„зІ’еҫғь/span>-ж•°йҮҸеӣҫи°ұпјҢеҸҜзҹҘдёҚеҗҢзІ’еҫ„зІ’еӯҗзҡ„еҲҶеёғеҸҠе…¶ж•°йҮҸгҖӮдёӨз§Қж–№жі•з»“еҗҲеҲҶжһҗпјҢеҸҜд»ҘжӣҙеҘҪзҡ„жҺ§еҲ¶йў—зІ’зҡ„иҙЁйҮҸгҖҒь/span>
е…ӯгҖҒзҫҺеӣҪиҚҜе…·ь/span><USP>еҜ№зІ’еҫ„жЈҖжөӢиҰҒжұӮзҡ„еҸҳеҢ–
2004е№іь/span>10жңҲпјҢзҫҺеӣҪиҚҜе…ёеңЁе…Ёж–°зҡ„USP<729>з« иҠӮдёӯе…¬еёғдәҶи„ӮиӮӘд№ізІ’еәҰжөӢиҜ•иҰҒжұӮпјҢж–№жі•дёҖйҮҮз”ЁеҠЁжҖҒе…үж•Је°„жҲ–иҖ…зұіж°Ҹж•Је°„еҺҹзҗҶжөӢиҜ•и„ӮиӮӘд№ізҡ„е№іеқҮзІ’еҫ„пјҢ规е®ҡејәеәҰеҖјпјҲInt-Weightпјүпјӣж–№жі•дәҢйҮҮз”Ёе…үйҳ»жі•з»ҹи®Ў1.8Ојm-50Ојmзҡ„и„ӮиӮӘд№ійў—зІ’дҪ“з§ҜеңЁжІ№зӣёдҪ“з§Ҝдёӯзҡ„жҜ”дҫҠь/span>пјҮь/span>PFAT5пјҲь/span>еҖјдёҚеҫ—и¶…иҝҶь/span>0.05%пјҢжңүдәҶеҜ№е°ҫз«ҜеӨ§зІ’еӯҗжҳҺзЎ®зҡ„规е®ҡгҖҒь/span>
2007е№іь/span>11жңҮь/span>USP<729>еңЁж–№жі•дёҖдёӯеҒҡдәҶеҸҳеҠЁпјҢеҜ№дәҺи„ӮиҙЁдҪ“жіЁе°„еүӮдёӯзҡ„ж•ҙдҪ“зІ’еҫ„еҲҶеёғиҝӣиЎҢдәҶж ҮеҮҶзҡ„规е®ҡпјҢж— и®әд№іеүӮж ·е“Ғзҡ„жө“еәҰеҰӮдҪ•пјҢз”ЁдәҺжіЁе°„д№іеүӮзҡ„е№іеқҮе…үејәзІ’еҫ„иҰҒе°ҸдәҚь/span>500nmжҲ•ь/span>0.5ОјmгҖҒь/span>
2010е№іь/span>USP<729>еңЁж–№жі•дәҢдёӯ延й•ҝдәҶжөӢиҜ•ж—¶й—ҙпјҢиҝҗиЎҢдёӨж¬Ўж ·е“ҒпјҢPFAT5еҖјеқҮдёҚеҫ—и¶…иҝҮ0.05%гҖҒь/span>
2013е№іь/span>11жңҲпјҢUSP<729>зҡ„жңҖж–°еҶ…容规е®ҡи„ӮиӮӘд№ід№іж»ҙе№іеқҮзІ’еҫ„еҲҶеёғйҮҮз”ЁеҠЁжҖҒе…үж•Је°„еҺҹзҗҶпјҢе°ҫз«ҜеӨ§дәҚь/span>5Ојmзҡ„д№іж»ҙпјҲPFAT5пјүеҚ жІ№зӣёдҪ“з§ҜжҜ”дҫӢйҮҮз”Ёе…үйҳ»жі•жөӢе®ҡпјҢжҳҺ确规е®ҡдәҶйў—зІ’зІ’еәҰеҲҶеёғзҡ„жЈҖжөӢж–№жі•гҖҒь/span>
еҸӮиҖғж–ҮзҢ?/span>
[1] Maryam Amidi,Markus de Raad, Daan J. A. Crommelin, etal. Antigen-expressing immunostimulatory liposomes as a genetically programmable synthetic vaccine[J]. Syst Synth Biol, 2011, 5:21-31.
[2]Egbaria K, Weiner N. Liposomes as a topical drug delivery system[J]. Adv Drug Del Rev 1990; 5:287вҖ?00.
[3]жқЁиүіиҠіпјҢи°ўеҗ‘йҳіпјҢжқЁйҳізӯүгҖӮзІ’еҫ„дёҺиЎЁйқўз”өиҚ·еҪұе“Қи„ӮиҙЁдҪ“дҪ“еҶ…иҚҜзү©йқ¶еҗ‘йҖ’йҖҒзҡ„з ”з©¶иҝӣеұ•[J]гҖҒь/span>иҚҜеӯҰеӯҰжҠҘ,2013, 48(11)пјҷь/span>1644-1650гҖҒь/span>
[4] Groves E, Dart AE, Covarelli V, et al. Molecular mechanisms of phagocytic uptake in mammalian cells[J]. Cell Mol Life Sci, 2008, 65:1957-1976.
[5] Champion JA,Mitragotri S. Role of target geometry in phagocytosis[J]. Proc Natl USA, 2006, 103:4930-4934.
[6] Dreher MR, Liu W, Michelich, CR, et al. Tumor vascular permeability, accumulation, and penetration of macromolecular drug carriers [J]. J Natl Cancer Inst, 2006, 98: 335-344.
[7] Shibata H, Saito H, Yomota C, et al. Pharmaceutical quality evaluation of lipid emulsions containing PGE1: alteration in the number of large particles in infusion solutions [J]. Int J Pharm, 2009, 378(1): 167-176.
[8] CU LLAR I, Bull NJ, Forgarini AM, et al. More efficient preparation of parenteral emulsions or how to improve a pharmaceutical recipe by formulation engineering[J]. Che Eng Sci, 2005, 60 (8-9): 2127 -2134.
[9]жҪҳдјҹзҘҘпјҢеҲҳжҙҒпјҢдҪ•еҶӣзӯүгҖӮеүҚеҲ—ең°е°”жіЁе°„ж¶Ій…ҚдјҚиҜ•йӘҢдёӯд№ізІ’зЁіе®ҡжҖ§зҡ„жҺўи®Ё[J]гҖҒь/span>ChineseJ. of New Drugs, 2013, 22 (18)гҖҒь/span>
- InVueВ® GV148 ж¶ІдҪ“жө“еәҰзӣ‘жөӢеҷ?/a>
- SemiChem еҚ•ж§ҪеЈҒжҢӮејҸеңЁзәҝжө“еәҰзӣ‘жөӢд»Ә
- SemiChem еңЁзәҝжө“еәҰзӣ‘жөӢд»?/a>
- Pharmsteriв„ўII PES0.22зј“еҶІеӣҠејҸиҝҮж»Өеҷ?/a>
- Pharmsteriв„ PTFEзӯ’ејҸиҝҮж»Өеҷ?/a>
- Dual Apex Mill ж№ҝејҸеҫ®зҸ зЈЁжңә(з ӮзЈЁжңәпјү
- Apex Mill з«ӢејҸзҸ зЈЁжңәпјҲз ӮзЈЁжңәпјү
- Apex LABO е°Ҹе®№йҮҸзҸ зЈЁжңәпјҲз ӮзЈЁжңәпјҲь/a>
- Ultra Apex MillзҸ зЈЁжңәпјҲз ӮзЈЁжңәпјү
- зҫҺеӣҪPSS FMS 380 OL CMPеңЁзәҝжЈҖжөӢд»Ә
- POUеңЁзәҝзІ’еәҰжЈҖжөӢд»Ә
- Apex LABO е°Ҹе®№йҮҸзҸ зЈЁжңәпјҲз ӮзЈЁжңәпјҲь/a>
- зҫҺеӣҪPSS Nicomp N3000 зәізұізІ’еәҰд»?/a>
- Xе°„зәҝеҲҶзҰ»иЎҢдёәеҲҶжһҗд»?/a>
- зҫҺеӣҪPSS Nicomp Z3000 зәізұізІ’еәҰд»ӘеҸҠZetaз”өдҪҚд»?/a>
- еңЁзәҝи®Ўж•°зІ’еҫ„жЈҖжөӢд»Ә
- зҫҺеӣҪPSS AccuSizer 780 A7000 APS еӨ§д№ізІ’еҲҶжһҗд»Ә
- PSS Nicomp 380 Z3000 zetaз”өдҪҚжЈҖжөӢд»Ә
иҷҡжӢҹеҸ·е°Ҷеңз§’еҗҺеӨұж•Ҳ
з«ӢеҚіжӢЁжү“дёәдәҶдҝқиҜҒйҡҗз§Ғе®үе…ЁпјҢе№іеҸ°е·ІеҗҜз”ЁиҷҡжӢҹз”өиҜқпјҢиҜ·ж”ҫеҝғжӢЁжү“
(жҡӮдёҚж”ҜжҢҒзҹӯдҝЎ)



