 钻石会员
钻石会员
 已认�?/p>
已认�?/p>

1 介绍
大容量肠外注射液(LVP)和小容量肠外注射�?SVP)是无菌注射药物。有两种广泛使用的方法来生产无菌药物产品:灭菌单元组件的终端灭菌和无菌处理。对于终端灭菌,在大多数情况下,产品、容器和封闭物具有低生物负载但在灌装时不是无菌的。该产品在最终容器中进行灭菌,通过无菌处理,产品受到微生物污染的风险高于终端灭菌。在无菌灌装过程中,产品、容器和封盖分别进行灭菌,然后在极高质量的环境条件下组合。无菌药物只有在终端灭菌不可行的情况下才能使用无菌处理来制造,这是一个公认的原则、�/p>
LVP是包装在标记为含有超�?00mL的容器中的无菌药物。大多数是终端灭菌的,但是一些可以通过过滤灭菌并无菌处理。SVP是包装在标记为含有少�?00mL的容器中的无菌药物。它们可以分为不同类型,包括预填充注射器、安瓿瓶或冻干粉末。许多SVP是热不稳定的,需要灭菌过滤和无菌处理、�/p>
2 典型的LVP/SVP生产过程
为了尽量减少微生物、颗粒和热原污染的风险,无菌产品制造需要特殊的工艺。灭菌过滤是任何无菌过程的关键部分,无菌过程是从流体中去除微生物而不会对产品质量产生不利影响。典型的应用包括液体和空�?气体无菌过滤、�/p>
多种因素会影响任何消毒过滤过程的有效性,包括微生物的类型和数量、液体的性质、过滤器设计和膜聚合物以及过滤过程参数。对于最终灭菌的产品,散装溶液过程应包括带有微生物还原过滤器或灭菌级过滤器的过滤步骤,以在填充最终产品容器之前控制生物负载水平和颗粒,图1、�/p>
如果产品不能在最终容器中灭菌,溶液或液体应通过灭菌级过滤器过滤灭菌。由于无菌过滤过程的潜在附加风险,与其他灭菌过程相比,应考虑通过无菌灭菌级过滤器进行第二次过滤,这也称为冗余过滤,图2、�/p>
大容量肠外注射液(LVP)
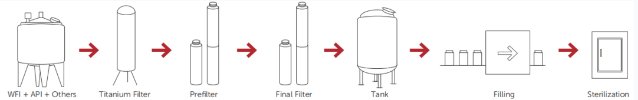
�?. 典型的LVP制造工艺、�/p>
小容量肠外注射液(SVP)

�?. 典型的SVP制造工艺、�/p>
3 分离目标
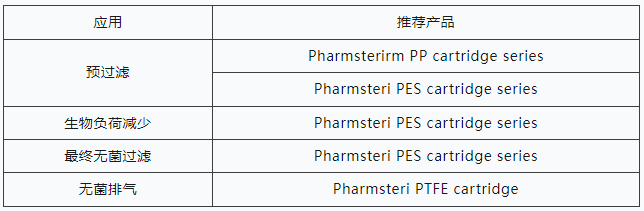
� 预过�?去除胶体和颗粒污染物,延长下游消毒过滤器的使用寿命、�/p>
� 最终过�?灭菌过滤是一个可以验证的过程,可以始终如一地产生无菌滤液。这最好通过使用具有极低活性药物成分(API)结合,低可萃取性和非致热原性的过滤器来实现。此外,灭菌过滤器必须经过完整性测试,并且易于灭菌或提供预灭菌、�/p>
4 LVP/SVP过滤建议
作为您可信赖的合作伙伴,Entegris致力于确保您在流程的每一步都能安心。在LVP/SVP生产过程中,我们拥有每个过滤步骤的过滤专业知识和技术。我们的产品组合将有助于提高无菌药物质量并优化您的生产体验、�/p>
有关详细的产品信息,请联系Alpharmaca、�/span>
5 监管合规
带硅胶密封圈或垫圈的滤芯符合USP�?8>塑料等级VI的要汁�/p>
所有成分均符合21 CFR 177-182中引用的美国食品药品监督管理局间接食品添加剂要汁�/p>
所有组件均符合(EC)第1935/2004叶�/p>
根据ISO 9001和ISO 13485认证的质量管理体系制速�/p>
符合USP和《中国药典》对SVP的颗粒要汁�/p>

版权声明
*本文章内容为上海奥法美嘉生物科技有限公司合法拥有版权或有权使用的作品,未经授权不得转载、摘编或利用其它方式使用上述作品。已经上海奥法美嘉生物科技有限公司授权使用作品的,应在授权范围内使用,并注明来源。违反上述声明者,上海奥法美嘉生物科技有限公司将追究其相关法律责任、�/p>







