 зҷҪйҮ‘дјҡе‘ҳ
зҷҪйҮ‘дјҡе‘ҳ
 е·Іи®ӨиҜ?/p>
е·Іи®ӨиҜ?/p>
еӨ–жіҢдҪ“иў«еҸ‘зҺ°иҮід»Ҡе·Іжңүиҝ?0е№ҙеҺҶеҸІпјҢеңЁз–ҫз—…иҜҠж–ӯгҖҒжІ»з–—е’ҢиҚҜзү©йҖ’йҖҒдёӯе…·жңүйқһеёёй«ҳзҡ„еә”з”ЁжҪңеҠӣгҖӮеӨ–жіҢдҪ“зҡ„еҠҹиғҪз ”з©¶д№ҹжҳҜзӣ®еүҚзҡ„з ”з©¶зғӯзӮ№пјҢе…¶дёӯж¶үеҸҠжңҖе…ій”®зҡ„жҠҖжңҜе°ұжҳҜеӨ–жіҢдҪ“зҡ„иЎЁеҫҒгҖӮзӣ®еүҚз ”з©¶дёӯеёёз”Ёзҡ„еӨ–жіҢдҪ“зҡ„иЎЁеҫҒж–№жі•жңүеҰӮдёӢ7з§ҚпјҢе…¶дёӯжөҒејҸз»ҶиғһжңҜиғҪеӨҹеҗҢж—¶жҸҗдҫӣзІ’еҫ„гҖҒжө“еәҰгҖҒиӣӢзҷҪеҲҶеһӢзӯүеӨҡз»ҙеәҰиЎЁеҫҒпјҢиҝӣиЎҢе®ҡжҖ§е’Ңе®ҡйҮҸзҡ„еҲҶжһҗгҖҒь/p>

дҪҶжҳҜжөҒејҸз»ҶиғһжңҜжҖҺж ·иЎЁеҫҒеӨ–жіҢдҪ“е‘ўпјһь/p>
д»ҠеӨ©жҲ‘们еҲҶдә«з”ұиҘҝе®үдәӨйҖҡеӨ§еӯҰеҢ»еӯҰйғЁеҹәзЎҖеҢ»еӯҰйҷўйҒ—дј дёҺеҸ‘иӮІз ”究жүҖй»„иҫ°ж•ҷжҺҲеӣўйҳҹжӣ№дёҪзӯүеҚҡеЈ«еҸ‘иЎЁзҡ„ж–Үз« гҖҠеҹәдәҺCytoFLEX жөҒејҸз»Ҷиғһд»Әзҡ„еӨ–жіҢдҪ“иЎЁеҫҒж–№жі•гҖӢпјҢеё®еҠ©еӨ§е®¶еҝ«йҖҹжҺҢжҸЎжөҒејҸз»ҶиғһжңҜзӣҙжҺҘиЎЁеҫҒеӨ–жіҢдҪ“зҡ„ж–°ж–№жі•гҖҒь/p>
Part.1
еӨ–жіҢдҪ“еҲҶзҰәь/strong>
1.1иЎҖжё…еӨ–жіҢдҪ“зҡ„еҲҶзҰәь/strong>
йҖҡиҝҮи¶…й«ҳйҖҹзҰ»еҝғжі•е’ҢиҜ•еүӮзӣ’жҸҗеҸ–дёӨз§Қж–№жі•жҸҗеҸ–иЎҖжё…жқҘжәҗеӨ–жіҢдҪ“гҖӮеҹәдәҺи¶…йҖҹзҰ»еҝғжі•пјҢе°ҶиЎҖжё…д»Ҙ 800 Г—gзҰ»еҝғ5 minпј?,000 Г—gзҰ»еҝғ10 minпјҢдёҠжё…з”Ё0.22 Ојm иҝҮж»ӨеҷЁиҝҮж»ӨгҖӮ然еҗҺпјҢе°?-6 mL иЎҖжөҶдёҺзӯүдҪ“з§Ҝзҡ„еҶ·PBSжә¶ж¶Іж··еҗҲпј?в„ғпјҢ100,000Г—gзҰ»еҝғ2 hпјҢжІүж·Җз”ЁPBSйҮҚжӮ¬гҖӮеҹәдәҺиҜ•еүӮзӣ’жҸҗеҸ–пјҢе°Ҷ 0.5 mL иЎҖжё…дёҺ0.5 mL зҡ„DBS-2жә¶ж¶Іж··еҗҲпј?в„ғпјҢ1,500Г—g зҰ»еҝғ20 minпјҢдёҠжё…дёҺ 252 ОјL ExoQuick еӨ–жіҢдҪ“жҸҗеҸ–иҜ•еүӮж··еҗҲпјҢ4в„ еӯөиӮІ1 hеҗ?,500 Г—g зҰ»еҝғ30 minпјҢжІүж·Җд»ҘPBSйҮҚжӮ¬пјҢеҲҶиЈ…еҗҺеӮЁеӯҳең? 80в„ғдҝқеӯҳгҖҒь/p>
1.2иӮҝзҳӨеӨ–жіҢдҪ“зҡ„еҲҶзҰ»
з»ҶиғһдёҠжё…иӮҝзҳӨеӨ–жіҢдҪ“зҡ„жҸҗеҸ–дё»иҰҒеҹәдәҺи¶…й«ҳйҖҹзҰ»еҝғж–№жі•пјҢеҰӮеүҚжүҖиҝ°е°Ҷз»ҶиғһдёҠжё…ж¶?00 Г—g зҰ»еҝғ5 minпј?,000 Г—g зҰ»еҝғ10 minд»ҘеҺ»йҷӨз»Ҷиғһе’Ңз»ҶиғһзўҺзүҮгҖӮ然еҗҺпјҢе°Ҷе…¶иҪ¬з§»еҲ°и¶…зҰ»з®ЎдёӯеңЁ 4в„ғпјҢ100,000 Г—gзҰ»еҝғ2h收йӣҶжІүж·ҖгҖӮ继з»ӯз”ЁPBSзј“еҶІж¶ІйҮҚжӮ¬пјҢеңЁзӣёеҗҢжқЎд»¶дёӢйҮҚеӨҚзҰ»еҝғиҺ·еҫ—еӨ–жіҢдҪ“жІүж·ҖгҖӮжҸҗеҸ–зҡ„еӨ–жіҢдҪ“еҲҶиЈ…еҗҺеӮЁеӯҳең?80в„ғпјҢйҒҝе…ҚеҸҚеӨҚеҶ»иһҚгҖҒь/p>
Part.2
еӨ–жіҢдҪ“зҡ„常规表еҫҒ
2.1 зәізұізІ’еӯҗиҝҪиёӘеҲҶжһҗ
е°ҶеӨ–жіҢдҪ“жӮ¬ж¶ІзЁҖйҮҠдәҺ1x107 / mL е’?x109 / mL д№Ӣй—ҙпјҢдҪҝз” Flow Nano AnalyzerиҝӣиЎҢеӨ–жіҢдҪ“зҡ„зәізұізІ’еӯҗи·ҹиёӘеҲҶжһҗпјҢд»ӘеҷЁйҖҡиҝҮж ҮеҮҶеҢ–йў—зІ’иҝӣиЎҢж ЎеҮҶгҖҒь/p>
2.2 йҖҸе°„з”өеӯҗжҳҫеҫ®й• (TEMпј?nbsp;
е°? ВөLеӨ–жіҢдҪ“жә¶ж¶ІзӯүеҲҶиҜ•ж ·зҪ®дәҺй“ңж¶ӮеұӮдёҠпјҢ并еңЁ2% зЈ·й’Ёй…ёдёӯиҙҹжҹ“иү?0 minгҖӮеңЁзҷҪзӮҪзҒҜдёӢе№ІзҮҘ2 minеҗҺпјҢдҪҝз”ЁйҖҸе°„з”өеӯҗжҳҫеҫ®й•ңиҝӣиЎҢеҸ–еӣҫгҖҒь/p>
2.3 Western blot
жҢүз…§ BCA иҜ•еүӮзӣ’зҡ„иҜҙжҳҺпјҢеңЁ96 еӯ”жқҝдёӯеҠ е…?0 ОјL ж ҮеҮҶе“Ғе’Ңж ·е“ҒпјҢ然еҗҺжҜҸеӯ”еҠ е…?00 ОјL е·ҘдҪңж¶ІпјҢ37в„ғеӯөиӮ?0 minеҗҺз”Ёй…¶ж Үд»ӘжөӢе®ҡиӣӢзҷҪжө“еәҰгҖӮ然еҗҺпјҢе°?0 Ојg еӨ–жіҢдҪ“иӣӢзҷҪеңЁ5 x SDS зј“еҶІж¶ІдёӯеҸҳжҖ§еҗҺпјҢ并ең?0% SDS-PAGEеҮқиғ¶дёӯиҝӣиЎҢеҲҶзҰ»пјҢжҒ’жөҒиҪ¬з§»еҲ°PVDF иҶңдёҠпј еҗҺз”Ё5%и„ұи„ӮзүӣеҘ¶е®Өжё©е°Ғй—ӯ1.5 hпјҢе°Ҹйј еҚ•е…ӢйҡҶжҠ—дҪ“ CD63гҖҒе°Ҹйј еҚ•е…ӢйҡҶжҠ—дҪ“ TSG101гҖҒе°Ҹйј еҚ•е…ӢйҡҶжҠ—дҪ“ CD81е’Ңе…”еӨҡе…ӢйҡҶжҠ—дҪ“CD171жҠ—дҪ“пј?:1000зЁҖйҮҠпјү4 в„ғиҝҮеӨңеӯөиӮІпјҢйҖҡиҝҮTBSTе……еҲҶжјӮжҙ—еҗҺдҪҝз”ЁеҗҢжәҗдәҢжҠ—пјҲ1:5000зЁҖйҮҠпјүе®Өжё©еӯөиӮІ 1hпјҢжјӮжҙ—еҗҺйҖҡиҝҮеҢ–еӯҰеҸ‘е…үд»ӘжҳҫиүІгҖҒь/p>
2.4 CytoFLEX жөҒејҸз»Ҷиғһд»Әзҡ„зІ’еҫ„еҲҶжһҗ
еҸ–еӨ–жіҢдҪ“жә¶ж¶Іпј?-10ОјLпјүз”ЁPBSзЈ·й…ёзӣҗе№іиЎЎжә¶ж¶ІиҝӣиЎҢжўҜеәҰзЁҖйҮҠпјҢеёёиҝӣиЎ?0еҖҚгҖ?00еҖҚе’Ң1000еҖҚзЁҖйҮҠпјҢеҗҺеҲ©з”ЁCytoFLEXжөҒејҸз»Ҷиғһд»ӘеҲқжӯҘз”ЁдәҺжЈҖжөӢEVйў—зІ’зҡ„ж•°йҮҸд»ҘйҖүжӢ©жңҖеҗҲйҖӮзҡ„зЁҖйҮҠжө“еәҰпјҲе№іеқҮжөҒйҖҹе°Ҹдә?0,000дё?sпјүгҖӮеңЁеҗҲйҖӮзЁҖйҮҠеҖҚж•°дёӢпјҢд»ҘзӣёеҗҢйў—зІ’ж•°жҲ–зӣёеҗҢдҪ“з§Ҝж•°дёәз»ҲжӯўжқЎд»¶иҝӣиЎҢеӨ–жіҢдҪ“жөӢе®ҡгҖҒь/p>
2.5 CytoFLEX жөҒејҸз»Ҷиғһд»Әзҡ„еҲҶеӯҗиЎЁеҫҒ
йҖүе®ҡеҗҲйҖӮзЁҖйҮҠеҖҚж•°еҗҺпјҢеҠ е…Ҙ1 Ојg PE- CD81жҠ—дҪ“гҖ APC-CD63жҲ–PE- CD171жҠ—дҪ“еҗҺж ·жң¬иҝӣиЎҢе……еҲҶж··еҢҖпјҢе®Өжё©йҒҝе…үеӯөиӮ 15 minеҗҺдҪҝз” CytoFLEX жөҒејҸз»Ҷиғһд»ӘжЈҖжөӢеҲҶеӯҗиЎЁиҫҫгҖҒь/p>
е®һйӘҢз»“жһң
Part.1
еӨ–жіҢдҪ“зҡ„常规表еҫҒ
еҜ№зӣёеҗҢжқҘжәҗиЎҖж¶Іж ·жң¬еҲҶеҲ«йҮҮз”ЁиҜ•еүӮзӣ’жі•е’Ңи¶…й«ҳйҖҹзҰ»еҝғжі•иҝӣиЎҢеӨ–жіҢдҪ“еҲҶзҰ»пјҢ并еҲ©з”ЁйҖҸе°„з”өй•ңгҖҒзІ’еҫ„жЈҖжөӢе’ҢиӣӢзҷҪиҙЁеҚ°иҝ№йүҙе®ҡиҝӣиЎҢеӨ–жіҢдҪ“зҡ„常规表еҫҒпјҢиЎЁеҫҒз»“жһңеҰӮеӣҫ 1 жүҖзӨәгҖҒь/p>
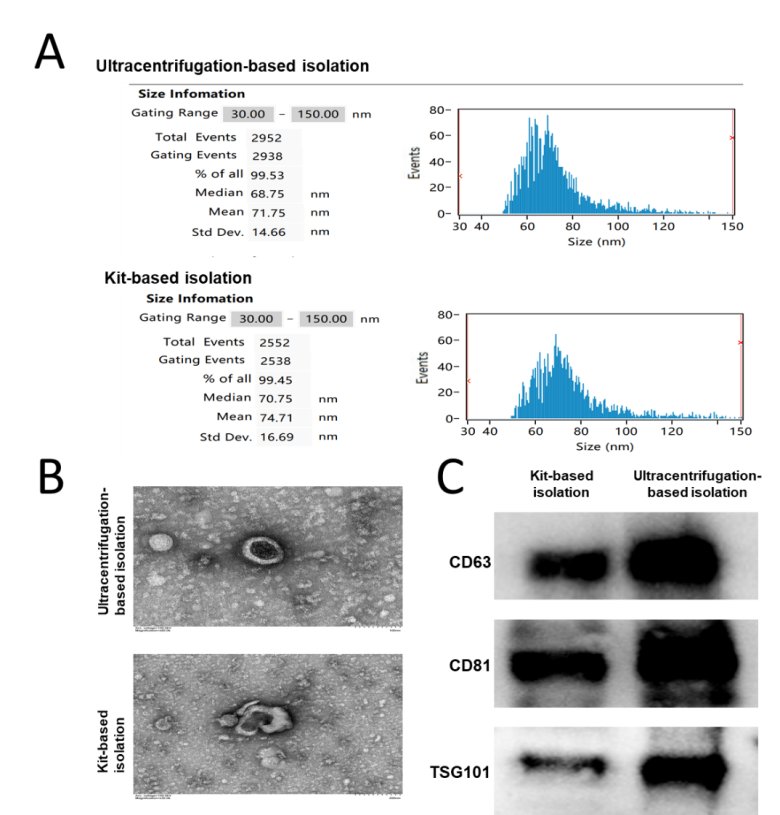
еӣ 1 иЎҖж¶ІжқҘжәҗеӨ–жіҢдҪ“зҡ„常规表еҫ?/p>
A. еӨ–жіҢдҪ“зҡ„зәізұізІ’еӯҗиҝҪиёӘеҲҶжһҗгҖӮB. еҹәдәҺиҜ•еүӮзӣ’жі•е’Ңи¶…й«ҳйҖҹзҰ»еҝғжі•еңЁйҖҸе°„з”өеӯҗжҳҫеҫ®й•ңдёӢзҡ„еӨ–жіҢдҪ“еӣҫеғҸгҖӮC. Western blotжЈҖжөӢеӨ–жіҢдҪ“ж Үеҝ—иӣӢзҷҪCD63гҖҒCD81 е’ TSG101зҡ„иЎЁиҫҫгҖҒь/p>
Part.2
жөҒејҸз»ҶиғһжңҜйүҙе®ҡзІ’еҫ„е’ҢеӨ–жіҢдҪ“ж Үеҝ—зү©
йҰ–е…ҲпјҢеҹәдәҺе·ІзҹҘзІ’еҫ„еӨ§е°Ҹзҡ„ж ҮеҮҶеҢ–еҫ®зҗғе®һзҺ°д»ӘеҷЁзҡ„ж ЎжӯЈпјҢ并жңүж•ҲеңҲе®ҡзІ’еҫ„еҢәеҹҹпјҲеӣҫ2AпјүгҖӮ然еҗҺпјҢжўҜеәҰзЁҖйҮҠеҗҺзҡ„ж ·жң¬з»ҸжөҒејҸжөӢе®ҡпјҢе®һйӘҢз»“жһңжё…жҷ°зҡ„жҳҫзӨәдәҶж ·е“Ғзҡ„зІ’еәҰеҲҶеёғпјҢеҸ‘зҺ°з»қеӨ§йғЁеҲҶйў—зІ’е°әеҜёе°Ҹдә?50nmпјҢе°ҸйғЁеҲҶйў—зІ’иҒҡйӣҶең?50-300nmд№Ӣй—ҙпјҢиҝҷдёҺ规е®ҡзҡ„еӨ–жіҢдҪ“еӨ§е°Ҹзӣёз¬ҰпјҲеӣ 2BпјүгҖӮдёәиҝӣдёҖжӯҘдәҶйүҙе®ҡж ·е“Ғзҡ„еҫ®еӣҠжіЎз»“жһ„пјҢжҲ‘们еҗ‘ж ·жң¬дёӯеҠ е…ҘTriton X-100д»Ҙз ҙеқҸеӣҠжіЎз»“жһ„пјҢз»“жһңиЎЁжҳҺеҠ е…ҘTriton X-100зҡ„ж ·жң¬йў—зІ’еӨ§е°ҸеҸ‘з”ҹжҳҺжҳҫеҸҳеҢ–пјҲеӣ?CпјүгҖӮжӯӨеӨ–пјҢйҖҡиҝҮеҗ‘зЁҖйҮҠеҗҺж ·жң¬еҠ е…ҘPE-CD81жҲ–APC-CD63пјҢд»ҺиҖҢзӣҙжҺҘйҖҡиҝҮCytoFLEX жөҒејҸжЈҖжөӢеӨ–жіҢдҪ“ж Үеҝ—иӣӢзҷҪеҗ«йҮҸпјҢе®һйӘҢз»“жһңиЎЁжҳҺж ·жң¬дёӯCD81зҡ„иЎЁеҫҒзҺҮдё?9.79%пјҢCD63иЎЁеҫҒзҡ„йў—зІ’еҚ 70.55%пјҲеӣҫ2DпјүгҖҒь/p>
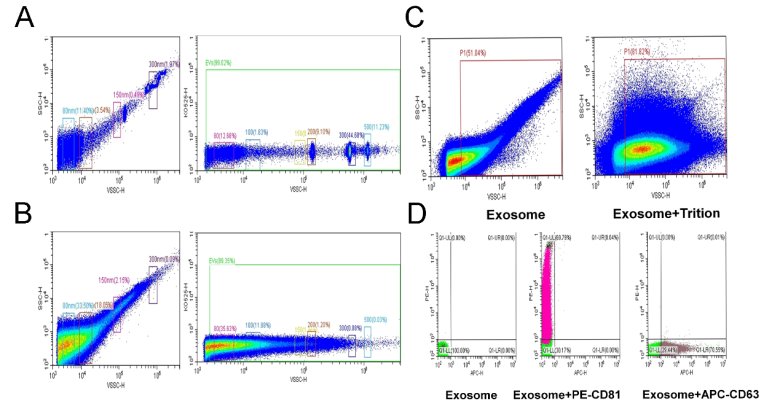
еӣ 2 жөҒејҸз»ҶиғһжңҜйүҙе®ҡзІ’еҫ„е’ҢеӨ–жіҢдҪ“иЎЁйқўж Үеҝ—иӣӢзҷјь/p>
A. ж ҮеҮҶеҢ–еҫ®зҗғиҝӣиЎҢд»ӘеҷЁж ЎеҮҶгҖӮB. еӨ–жіҢдҪ“ж ·е“ҒзІ’еҫ„еҲҶеёғжғ…еҶөгҖӮC. еҠ е…Ҙ Triton X-100 еҗҺзІ’еҫ„еҲҶеёғжғ…еҶөгҖӮD. PE-CD81жҲ–APC-CD63ж Үи®°еӨ–жіҢдҪ“зҡ„иЎЁеҫҒзҺҮеҲҶжһҗгҖҒь/p>
Part.3
жөҒејҸз»Ҷиғһд»Әе®ҡйҮҸиЎЁеҫҒеӨ–жіҢдҪ“иӣӢзҷҪ
з”ұдәҺеӨ–жіҢдҪ“зјәе°‘еҶ…еҸӮиӣӢзҷҪпјҢеҜ№еӨ–жіҢдҪ“зӣёе…іеҲҶеӯҗзҡ„е®ҡйҮҸеҲҶжһҗдёҖзӣҙеӯҳеңЁдәүи®®пјҢиҖҢCytoFLEX жөҒејҸеҹәдәҺзӣёеҗҢдҪ“з§ҜжҲ–еӣәе®ҡж•°йҮҸзҡ„ж–№жі•е°ҶдёәеӨ–жіҢдҪ“зӣёе…іиӣӢзҷҪзҡ„з ”з©¶жҸҗдҫӣжӣҙдёәзӣҙжҺҘзҡ„еҲҶжһҗж–№жі•гҖӮжҲ‘们еҲ©з”ЁCytoFLEX жөҒејҸз»Ҷиғһд»Әд»ҘзӣёеҗҢйў—зІ’ж•°дёәз»“жқҹжқЎд»¶иҝӣиЎҢCD63гҖҒCD81е’ CD171зҡ„иЎЁеҫҒжғ…еҶөжЈҖжөӢпјҢеҸ‘зҺ°иЎЁеҫҒзҺҮеҲҶеҲ«дёәдё?0.12%гҖ?5.47%е’ 22.74%пјҲеӣҫ3пјүгҖҒь/p>

еӣ 3 жөҒејҸз»Ҷиғһд»Әе®ҡйҮҸиЎЁеҫҒеӨ–жіҢдҪ“иӣӢзҷҪ
Part.4
жөҒејҸйүҙе®ҡеҲҶзҰ»ж–№жі•еҜ№еӨ–жіҢдҪ“ж Үи®°зҺҮзҡ„еҪұе“Қ
еҜ№дәҺеҗҢдёҖиЎҖжё…ж ·жң¬пјҢжҲ‘们еҲҶеҲ«дҪҝз”Ёи¶…й«ҳйҖҹзҰ»еҝғжі•е’ҢиҜ•еүӮзӣ’жі•еҲҶеҲ«иҝӣиЎҢжҸҗеҸ–пјҢеҗҺз»ҸжөҒејҸжЈҖжөӢдёӨз§Қж–№жі•иҺ·еҸ–зҡ„еӨ–жіҢдҪ“зҡ„зІ’еҫ„еҲҶеёғд»ҘеҸҠж Үеҝ—зү©иЎЁеҫҒжғ…еҶөгҖӮйҖҡиҝҮжҜ”иҫғзІ’еҫ„еӨ§е°ҸеҸ‘зҺ°пјҢеҹәдәҺиҜ•еүӮзӣ’жі•еҲҶзҰ»зҡ„иЎҖжё…жқҘжәҗеӨ–жіҢдҪ“зҡ„зІ’еҫ„жҳҺжҳҫй«ҳдәҺеҹәдәҺи¶…йҖҹзҰ»еҝғзҡ„ж–№жі•еҲҶзҰ»зҡ„еӨ–жіҢдҪ“зІ’еҫ„пјҢеҗҢж—¶еҸ‘зҺ°еҹәдәҺиҜ•еүӮзӣ’ж–№жі•жҸҗеҸ–зҡ„еӨ–жіҢдҪ“иҒҡйӣҶеҲ°зҡ„жӣҙеӨҡзҡ„еӨ§е°әеҜёйў—зІ’пј?50 nmеӨ„еҚ жҜ?.38%пјҲеӣҫ4AпјүгҖӮе°ҶжүҖжңүж ·жң¬дёҺPE-CD81жҲ–APC-CD63ж··еҗҲеӯөиӮІеҗҺпјҢеҸ‘зҺ°дёӨз§Қж–№жі•еҲҶзҰ»зҡ„еӨ–жіҢдҪ“еқҮжЈҖжөӢеҲ°CD81е’ҢCD63зҡ„иЎЁиҫҫпјҢе№іеқҮиЎЁеҫҒзҺҮеӨ§дә?0%гҖҒь/p>
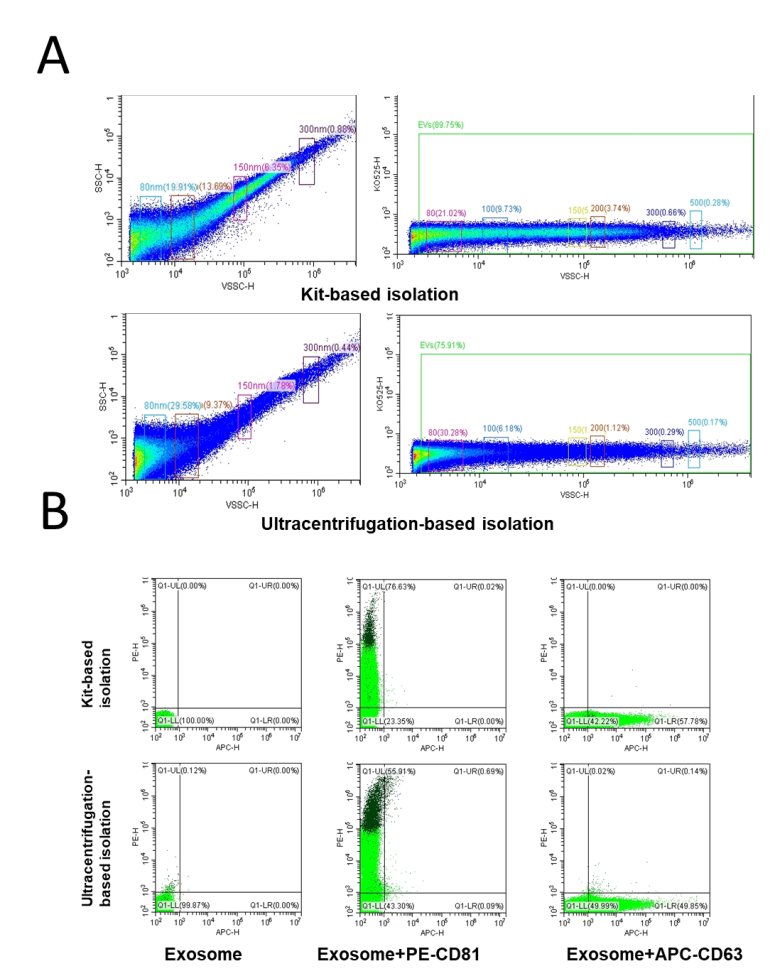
еӣ 4 жөҒејҸйүҙе®ҡеҲҶзҰ»ж–№жі•зҡ„еӨ–жіҢдҪ“зІ’еҫ„е’Ңж Үеҝ—иӣӢзҷҪиЎЁеҫҒзҺҮ
Part.5
иҒ”еҗҲж Үи®°еңЁеӨ–жіҢдҪ“жЈҖжөӢдёӯзҡ„жҺўз©өь/strong>
еңЁжҲҗеҠҹе®һзҺ°PE-CD81жҲ–APC-CD63еҚ•зӢ¬ж Үи®°жЈҖжөӢеӨ–жіҢдҪ“зҡ„еҹәзЎҖдёҠпјҢжҲ‘们з§ҜжһҒжҺўзҙўеӨ–жіҢдҪ“зҡ„иҒ”еҗҲж Үи®°гҖӮжҲ‘们еҜ№йҮҮз”ЁдёҚеҗҢжҸҗеҸ–ж–№жі•зҡ„иЎҖжё…жқҘжәҗеӨ–жіҢдҪ“иҝӣиЎҢиҒ”еҗҲж Үи®°жЈҖжөӢпјҢз»“жһңиЎЁжҳҺиҜ•еүӮзӣ’жі•жҸҗеҸ–зҡ„еӨ–жіҢдҪ“CD81+CD63 иҒ”еҗҲж Үи®°зҡ„иЎЁеҫҒзҺҮдё 81.60%пјҢиҖҢи¶…й«ҳйҖҹзҰ»еҝғжҸҗеҸ–зҡ„еӨ–жіҢдҪ“иЎЁеҫҒзҺҮдё 15.39%пјҢеҗҢж—¶иҜ•еүӮзӣ’жҸҗеҸ–ж ·жң¬иҒҡйӣҶеҲ°жӣҙй«ҳзІ’еҫ„зҡ„йў—зІ’пјҲеӣҫ 5пјүгҖӮиҝҷдёҖз ”з©¶иЎЁжҳҺCytoFLEX жөҒејҸеҸҜд»Ҙз”ЁдәҺеӨҡз§ҚеҲҶеӯҗзҡ„иҒ”еҗҲжЈҖжөӢпјҢиҖҢиҝҷе°ҶдёәеӨ–жіҢдҪ“зӣёе…іеҲҶеӯҗзҡ„иҒ”еҗҲжЈҖжөӢжҸҗдҫӣжӣҙеӨҡзҡ„еҸҜиғҪгҖҒь/p>
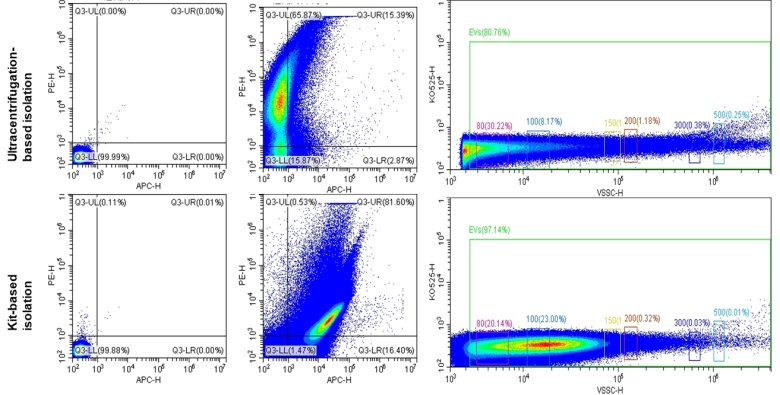
еӣ 5 CD81е’ҢCD63иҒ”еҗҲж Үи®°иЎЁеҫҒеӨ–жіҢдҪ’ь/p>
жҖ»з»“
иҝҷзҜҮж–Үз« йҖүжӢ©з»ҸйҖҸе°„з”өй•ңгҖҒзәізұійў—зІ’иҝҪиёӘгҖҒWestern blotж–№жі•иҝӣиЎҢ常规表еҫҒеҗҺзҡ„еӨ–жіҢдҪ“пјҢжҢүз…§10еҖҚгҖ?00еҖҚе’Ң1000еҖҚжўҜеәҰзЁҖйҮҠеҗҺдҫқжүҳCytoFLEXжөҒејҸз»Ҷиғһд»ӘиҝӣиЎҢйүҙе®ҡпјҢе№¶з ”з©¶дёҚеҗҢеҲҶзҰ»ж–№жі•гҖҒдёҚеҗҢи¶…зҰ»ж¬Ўж•°еҜ№еӨ–жіҢдҪ“зү№жҖ§зҡ„еҪұе“ҚпјҢеҗҢж—¶иҝӣдёҖжӯҘжҺўз©¶иҒ”еҗҲж Үи®°еңЁеңЁеӨ–жіҢдҪ“иЎЁеҫҒзҡ„еә”з”ЁеҸҜиғҪжҖ§гҖҒь/p>
иҜҘж–№жі•еҸҜд»Ҙз”ЁдәҺеҲҶжһҗж ·жң¬зҡ„зІ’еҫ„еӨ§е°ҸеҲҶеёғжғ…еҶөгҖҒж Үеҝ—зү©иӣӢзҷҪиЎЁеҫҒжғ…еҶөд»ҘеҸҠеӨ–жіҢдҪ“зӣёе…іеҲҶеӯҗзҡ„иЎЁиҫҫпјҢиҝҷе°ҶжһҒеӨ§дё°еҜҢеӨ–жіҢдҪ“иЎЁеҫҒе·ҘдҪңгҖӮ并且еҹәдәҺCytoFLEX жөҒејҸеҲҶжһҗд»…йңҖ5-10 ОјLеӨ–жіҢдҪ“жӮ¬жө®ж¶ІпјҢдёҖзі»еҲ—ж“ҚдҪңд№ҹеҸҜең?-2 hеҶ…е®ҢжҲҗпјҢиҝҷе°ҶеӨ§еӨ§иҠӮзңҒдәҶе®һйӘҢжҲҗжң¬е’ҢжҸҗй«ҳе®һйӘҢйҖҹеәҰгҖҒь/p>

в— еҸӮиҖғж–ҮзҢ®пјҡ
[1]жӣ№дёҪзӯ? "еҹәдәҺCytoFLEXжөҒејҸз»Ҷиғһд»Әзҡ„еӨ–жіҢдҪ“иЎЁеҫҒж–№жі?" зҺ°д»Јд»ӘеҷЁдёҺеҢ»з– 29.3(2023):39-46.
- Allegra C-34Rе°ҸеһӢеҸ°ејҸй«ҳйҖҹеҶ·еҶ»зҰ»еҝғжңә
- Optima MAX-XPеҸ°ејҸи¶…йҖҹзҰ»еҝғжңә
- Optima XPN зі»еҲ—и¶…йҖҹзҰ»еҝғжңә
- иҙқе…Ӣжӣјеә“е°”зү№HIAC 9703+е®һйӘҢе®Өж¶ІдҪ“йў—зІ’и®Ўж•°еҷЁ
- иҙқе…Ӣжӣјеә“е°”зү№Multisizer 4eйў—зІ’/з»Ҷиғһи®Ўж•°еҸҠзІ’еәҰеҲҶжһҗд»Ә
- LS 13 320 XR зІ’еәҰеҲҶжһҗд»?/a>
- Microfuge 20 й«ҳйҖҹзҰ»еҝғжңә
- MicrofugeВ® 16еҸ°ејҸеҫ®йҮҸзҰ»еҝғжң№ь/a>
- Optima XE зі»еҲ—и¶…йҖҹзҰ»еҝғжңә
- Optima XE зі»еҲ—и¶…йҖҹзҰ»еҝғжңә
- иҙқе…Ӣжӣјеә“е°”зү№Anatel PAT700 TOCеҲҶжһҗд»?/a>
- иҙқе…Ӣжӣјеә“е°”зү№MET ONE 6000PиҝңзЁӢз©әж°”йў—зІ’и®Ўж•°еҷ?/a>
- Microfuge 20 й«ҳйҖҹзҰ»еҝғжңә
- иҙқе…Ӣжӣјеә“е°”зү№MET ONE 6000иҝңзЁӢз©әж°”йў—зІ’и®Ўж•°еҷ?/a>
- MicrofugeВ® 16еҸ°ејҸеҫ®йҮҸзҰ»еҝғжң№ь/a>
- иҙқе…Ӣжӣјеә“е°”зү№HIAC 9703+е®һйӘҢе®Өж¶ІдҪ“йў—зІ’и®Ўж•°еҷЁ
- Optimaв„ MAX-TLеҸ°ејҸи¶…йҖҹзҰ»еҝғжңә
- Avanti J-15R й«ҳйҖҹеҶ·еҶ»зҰ»еҝғжңә


