 зҷҪйҮ‘дјҡе‘ҳ
зҷҪйҮ‘дјҡе‘ҳ
 е·Іи®ӨиҜ?/p>
е·Іи®ӨиҜ?/p>

иҙқе…Ӣжӣјеә“е°”зү№еҹәдәҺSPRIжҠҖжңҜзҡ„AMPure XPеҸүь/span>SPRIselectдёӨз§ҚNGSж–Үеә“зәҜеҢ–е’ҢзүҮзӯӣиҜ•еүӮ已家喻жҲ·жҷ“гҖӮиҜҘжҠҖжңҜйҮҮз”ЁйЎәзЈҒжҖ§зҡ„зЈҒзҸ гҖҒйҖүжӢ©жҖ§зҡ„з»“еҗҲзү№е®ҡеӨ§е°Ҹзҡ„ж ёй…ёпјҢиў«дј—еӨҡдё»жөҒе»әеә“иҜ•еүӮзӣ’еҸҠжөӢеәҸ专家жҢҮе®ҡйҖүз”ЁгҖҒь/span>
йӮЈд№ҲпјӢь/span>вҖӣь/span>йҮ‘ж ҮеҮ…ь/span>вҖңь/span>иҝҳжңүдјҳеҢ–зҡ„з©әй—ҙеҗ—пјҹи®©еҺҹеҺӮжқҘз»ҷжӮЁдё“дёҡзҡ„еҲҶжһҗпјҡеҚ•д»Һжҙ—и„ұпјҢжңүе“ӘдәӣдјҳеҢ–зҡ„йҮҚзӮ№гҖҒь/span>
з”Ёд»Җд№Ҳжҙ—пјһь/span>
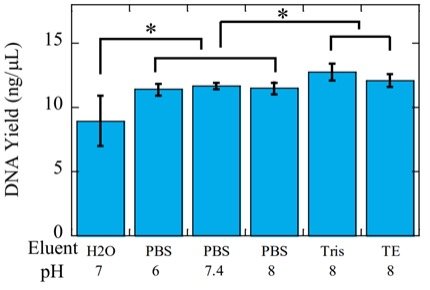
еҰӮдёҠеӣҫжүҖзӨ№ь/span>:ең?/span>Tris or TE buffer (+/-EDTA)дёӯпјҢжҙ—и„ұеҫ—зҺҮзӣёжҜ”дәҺзәҜж°ҙжңүдәҶжҳҫи‘—жҸҗеҚҮгҖӮиҖӢь/span>PBSжә¶ж¶ІпјҮь/span>pH 6-8пјүзҡ„ж•Ҳжһңзҙ§йҡҸе…¶еҗҺпјҢдё”PHж— жҳҫи‘—еҪұе“ҚгҖӮиҝҷеҸҜиғҪдёҚь/span>PBSдёӯзҡ„зӣҗзҰ»еӯҗзҡ„еӯҳеңЁжңүе…ігҖӮеҸҰдёҖж–№йқўпјҢд»ҺзЁіе®ҡжҖ§пјҲCVпјүдёҠзңӢпјҢTrisTEPBSжҙ—и„ұйғҪдјҳдәҺж°ҙгҖҒь/span>
еҠ еӨҡе°‘пјҹ
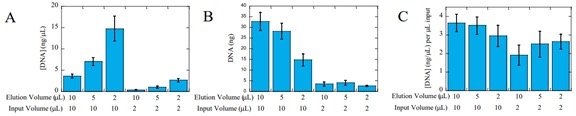
еҰӮдёҠеӣҫжүҖзӨәпјҡеҜ№жҜ”дәҶдёҚеҗҢеҠ ж ·дҪ“з§ҜеҸҠжҙ—и„ұдҪ“з§Ҝзҡ„еҪұе“ҚгҖӮжүҖжңүзҡ„DNAиө·е§Ӣжө“еәҰдёҖиҮҙпјҢеӣ жӯӨжҙ—и„ұдҪ“з§Ҝи¶Ҡе°ҸпјҢдә§зү©зӣёеҜ№жө“еәҰи¶Ҡй«—ь/span>(A)пјӣдҪҶжҳҜз”ұдәҺзЈҒзҸ д№ҹдјҡеҚ з”ЁдёҖйғЁеҲҶжҙ—и„ұжә¶ж¶Ізҡ„дҪ“з§ҜпјҲзә?/span>1 ВөLпјүпјҢдә§зү©жө“еәҰи¶Ҡй«ҳеҲҷиҝҷйғЁеҲҶжҚҹеӨұи¶ҠеӨҡ(B)пјӣиҷҪ然е°ҸдҪ“з§Ҝжҙ—и„ұдјҡеҫ—еҲ°еҪұе“Қж ёй…ёзҡ„еҫ—зҺҮпјҢдҪҶжҳҜиҝҷ并дёҚжҳҜеӣ дёәжҙ—и„ұж•ҲзҺҮеј•иө·зҡ„пјҡеҪ“жҠ•е…ҘйҮҸдёҖиҮҙж—¶пјҢдёҚеҗҢжҙ—и„ұдҪ“з§Ҝзҡ„еҫ—зҺҮж— жҳҫи‘—е·®ејҒь/span>(C)гҖҒь/span>
жҙ—еӨҡд№…пјҹеҠ зғӯеҗ—пјҹ
еҰӮдёҠеӣҫжүҖзӨәпјҡең?/span>1еҲҶй’ҹзҡ„ж—¶еҖҷпјҢжҙ—и„ұе·Із»Ҹиҝӣе…Ҙе№іеҸ°жңҹпјҲйқһжҢҮж•°жңҹпјүжҸҗзӨәеӨ§еӨҡж•°ж ёй…ёе·Із»Ҹжҙ—и„ұдёӢжқҘгҖӮдёҚеҠ зғӯзҡ„жғ…еҶөдёӢпјӢь/span>1еҲҶй’ҹдёҚь/span>20еҲҶй’ҹжҙ—и„ұзӣёжҜ”пјӢь/span>1еҲҶй’ҹзҡ„йҮҸжҳҫи‘—еҒҸдҪҺпјҮь/span>p < 0.01)гҖӮд»Һ2еҲҶй’ҹжҙ—и„ұејҖе§ӢпјҢж— жҳҫи‘—е·®ејӮгҖӮеҠ зғӯиҮі60еәҰеҗҺпјҢжҙ—и„ұйҖҹеәҰжӣҙеҝ«пјҷь/span>1еҲҶй’ҹдёҺе…¶д»–ж—¶й•ҝж— жҳҫи‘—е·®ејӮгҖҒь/span>
е°Ҹз»“
дёҠиҝ°е®һйӘҢйҖҡиҝҮдҪҝз”Ёlambda phage DNA (49 kb)пјҢеҜ№иҙқе…Ӣжӣјеә“е°”зү№зҡғь/span>SPRIжҠҖжңҜзЈҒзҸ иҝӣиЎҢжөӢиҜ•пјҢжҸҗзӨәпјҷь/span>
й•ҝиҫҫ49 kbзҡ„ж ёй…ёзүҮж®ҙь/span>2еҲҶй’ҹеҸҜд»Ҙиў«е……еҲҶжҙ—и„ұгҖҒь/span>
дҪҝз”ЁTrisжә¶ж¶ІеҸҜд»ҘжҸҗеҚҮжҙ—и„ұж•ҲзҺҮе’ҢзЁіе®ҡжҖ§гҖҒь/span>
дёҚеҗҢзҡ„иө·е§ӢеҸҠжҙ—и„ұдҪ“з§ҜеҜ№жҙ—и„ұж•ҲзҺҮеҪұе“ҚдёҚеӨ§гҖҒь/span>
дҪҶжҳҜе°ҸдҪ“з§Ҝзҡ„зү©зҗҶйҷҗеҲ¶дјҡеҜјиҮҙжӣҙеӨҡж ёй…ёжҚҹеӨұдәҺжӯ»дҪ“з§ҜгҖҒь/span>
- Allegra C-34Rе°ҸеһӢеҸ°ејҸй«ҳйҖҹеҶ·еҶ»зҰ»еҝғжңә
- Optima MAX-XPеҸ°ејҸи¶…йҖҹзҰ»еҝғжңә
- Optima XPN зі»еҲ—и¶…йҖҹзҰ»еҝғжңә
- иҙқе…Ӣжӣјеә“е°”зү№HIAC 9703+е®һйӘҢе®Өж¶ІдҪ“йў—зІ’и®Ўж•°еҷЁ
- иҙқе…Ӣжӣјеә“е°”зү№Multisizer 4eйў—зІ’/з»Ҷиғһи®Ўж•°еҸҠзІ’еәҰеҲҶжһҗд»Ә
- LS 13 320 XR зІ’еәҰеҲҶжһҗд»?/a>
- Microfuge 20 й«ҳйҖҹзҰ»еҝғжңә
- MicrofugeВ® 16еҸ°ејҸеҫ®йҮҸзҰ»еҝғжң№ь/a>
- Optima XE зі»еҲ—и¶…йҖҹзҰ»еҝғжңә
- Optima XE зі»еҲ—и¶…йҖҹзҰ»еҝғжңә
- иҙқе…Ӣжӣјеә“е°”зү№Anatel PAT700 TOCеҲҶжһҗд»?/a>
- иҙқе…Ӣжӣјеә“е°”зү№MET ONE 6000PиҝңзЁӢз©әж°”йў—зІ’и®Ўж•°еҷ?/a>
- Microfuge 20 й«ҳйҖҹзҰ»еҝғжңә
- иҙқе…Ӣжӣјеә“е°”зү№MET ONE 6000иҝңзЁӢз©әж°”йў—зІ’и®Ўж•°еҷ?/a>
- MicrofugeВ® 16еҸ°ејҸеҫ®йҮҸзҰ»еҝғжң№ь/a>
- иҙқе…Ӣжӣјеә“е°”зү№HIAC 9703+е®һйӘҢе®Өж¶ІдҪ“йў—зІ’и®Ўж•°еҷЁ
- Optimaв„ MAX-TLеҸ°ејҸи¶…йҖҹзҰ»еҝғжңә
- Avanti J-15R й«ҳйҖҹеҶ·еҶ»зҰ»еҝғжңә


